NOVO LETO – NOVO CEPIVO?
Priznajmo, leto 2020 je bilo v vseh pogledih novo, pa bo novo tudi leto, ki prihaja? Tega z gotovostjo ne more trditi noben, lahko pa povem, da bo na trgu zagotovo novo cepivo, ki je te dni kar »vroča roba«. Kot biotehnologinji se mi zdi tovrsten dosežek izjemen – v kar dobrega pol leta ugotoviti bistvo cepiva, opraviti vse klinične študije ter pridobiti dovoljenje za promet ni mačji kašelj (ha, kašelj, v 2021 ga več ne bo). Verjamem pa, da se nekaterim ob tej zadevi poraja eno in edino, največkrat zastavljeno vprašanje – bo cepivo varno? V nadaljevanju vam bom zato predstavila krajši molekularni vidik delovanja cepiva in vse okvirčke, ki jih mora cepivo obkljukati, da lahko pride v humano uporabo.
Naj začnem z nekaj klasičnimi besedami o cepivu. Dovoljenje za promet trenutno pridobiva več cepiv, sama se bom osredotočila na tistega s tehnologijo, ki sloni na uporabi informacijske RNA oz. »messenger« RNA molekule (v nadaljevanju mRNA), ker je ena izmed najzanimivejših in morda najnaprednejših načinov delovanja cepiva pa tudi, ker izbranemu cepivu trenutno najbolje kaže.
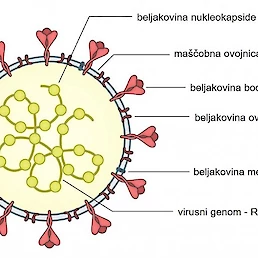
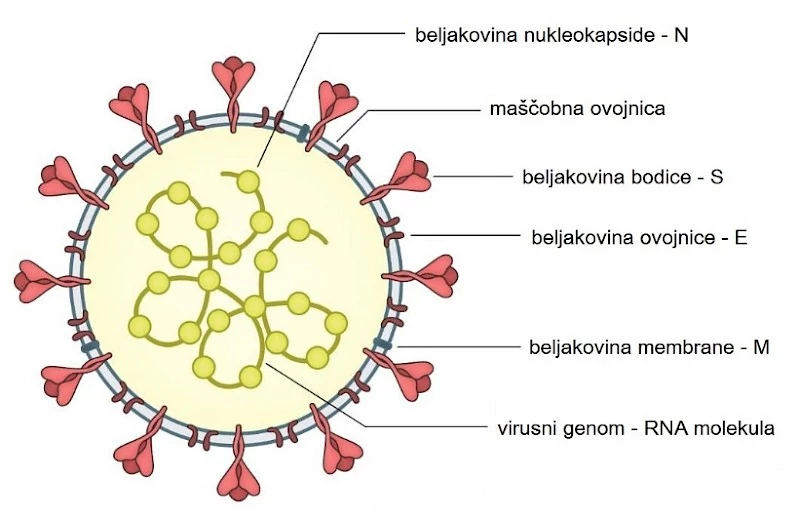
Koronavirus SARS-CoV-2 je virus iz družine ostalih koronavirusov in vsak virus se med sabo razlikuje po beljakovinskih strukturah (najmanj eni) na svoji ovojnici. In prav koronavirus ima eno izmed beljakovin (npr. beljakovina S, ki je potrebna za vezavo virusa na človeške celice in njegov vstop v njih), ki za naš imunski sistem predstavlja nerešljivo uganko, še nikoli prej videno beljakovino, za katero ne ve, kako bi se z njo spopadel. Naše imunske celice je ne prepoznajo in so jo nezmožne inaktivirati, virus pa si tako podredi naše telo. Težavo lahko rešimo s cepljenjem – v telo s cepivom vnesemo genetski mRNA zapis, ki nosi pomembno informacijo o izgradnji točno te določene beljakovine. Naše celice so zmožne prebrati ta zapis in ga pretvoriti v beljakovino, ki služi kot signal za naš imunski sistem. Imunskemu sistemu se zdi beljakovina tuja, zato začne proti njej izdelovati lastne obrambne celice in protitelesa. Ta pristop omogoča, da naše telo ob potencialnem stiku z virusom hitreje in lažje ustvari obrambne celice in tako inaktivira virus (celice ga uničijo, preprečijo njegov vstop v telesne celice gostitelja in uničijo že okužene celice), s tem pa pomaga pri zaščiti proti bolezni COVID-19. In nič bati – te »vnesene« beljakovine je tako malo, da ne izzove bolezni, omogoča pa učinkovito pripravo na okužbo z virusom, hkrati pa je to samo ena izmed več kot 20 beljakovin, ki tvorijo popoln virusni delec.
* Slika 1: shematski prikaz virusa s pomembnejšimi beljakovinami (vir: https://www.rtvslo.si/zdravje/alojz-ihan-cepijo-naj-se-tudi-ljudje-ki-so-preboleli-covid-19/545500)
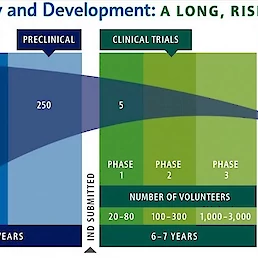
Vsako zdravilo mora čez določene stopnje razvoja in kliničnih študij – temu v stroki pravimo »research and development« oz. R&D (raziskave in razvoj). Razvoj novega zdravila lahko traja tudi do 15 let, če razčlenim:
- prva faza: 3–6 let primarnih raziskav in predkliničnih študij,
- druga faza: 6–7 let kliničnih študij (različno število testiranih prostovoljcev),
- tretja faza: do 2 leti ocene ustreznosti s strani regulatornih organov, kot sta FDA v Združenih državah Amerike in EMA v Evropi, ki sta odgovorni za podelitev dovoljenja za promet ter proizvodnja zdravila za večji trg uporabnikov.
** Slika 2: shema R&D (vir: http://phrma-docs.phrma.org/sites/default/files/pdf/12-535phrmaoverviewdiabetes1109.pdf)
Po 15 letih se nadzor in spremljanje novega zdravila ne zaključi. Morebitne neželene učinke, nadzor delovanja poteka ves čas uporabe zdravila. In zakaj bomo imeli cepivo na voljo že v manj kot enem letu, se morda sprašujete. No, odgovor na to je pogojno dovoljenje za promet, ki omogoča odobritev zdravil na podlagi manj popolnih podatkov v primeru, da je zdravilo ključno za zdravljenje ali preprečevanje bolezni, možno pa je le v primeru, ko je takojšnja korist uporabe večja od tveganja manjka podatkov.
Predklinične in klinične študije (največkrat izvedene v treh fazah, vsaka se razlikuje po številu testirancev) so eden najpomembnejših korakov izdelave zdravila (postopki so enaki tudi za cepiva). Predklinične študije nam podajo osnovne informacije o varnosti zdravila, ki pa se ne navezujejo na varnost pri aplikaciji v človeško tkivo – ta podatek pridobimo s pomočjo kliničnih študij, kamor so vključeni ljudje – testiranci. Za vsako klinično testiranje novega zdravila se oblikuje protokol, ki vsebuje informacije o tem, kdo lahko sodeluje v študiji, koliko ljudi bo testiranih, kako dolga bo študija, ali bo vključena testna skupina, kako bodo testiranci prejeli zdravilo in kako bo potekalo pridobivanje, vrednotenje ter analiza rezultatov. Faza 1: testiranih je 20–100 zdravih ali bolnih ljudi, njen namen pa je pregled varnosti zdravila in določitev optimalne koncentracije apliciranja zdravila, pripravi se tudi ocena varnosti cepiva glede na pojav morebitnih neželenih učinkov. Faza 2: več 100 bolnih ljudi, njen namen je preverjanje učinkovitosti in pojava možnih neželenih učinkov, preučitev predlaganih odmerkov in oblikovanje sheme zdravljenja in aplikacije zdravila. Faza 3: 300–3000 bolnih ljudi, njen namen je natančnejša ocena varnosti, natančnejše preverjanje učinkovitosti zdravila in monitoring škodljivih reakcij. Iz faze v fazo napredujejo samo zdravila, ki zadostijo vsem zahtevam posamezne faze.
V vsako študijo so vključeni različno stari udeleženci, moški in ženske, bolni in zdravi, nekateri testiranci prejmejo zdravilo, kontrolna skupina testirancev enake sestave pa placebo oz. navidezno zdravilo (zdravilo brez aktivne učinkovine, ki je po videzu in okusu enako kot pravo zdravilo – v primeru cepiva, brez mRNA molekule; testiranci v času raziskav ne vejo, ali so dobili pravo ali navidezno zdravilo). V primeru aktualnega zdravila je trajanje študij pospešeno prav iz razloga, ki sem ga opisala zgoraj (korist je večja od tveganja). Na spletu pa je javno dostopen tudi celoten, razumljiv protokol izvedbe kliničnih študij cepiva, ki sta ga razvila Pfizer in BioNTech. Vsi, ki vas o tem kaj več zanima, lahko v iskalnik vtipkate geslo C4591001_Clinical_Protocol_Nov2020.pdf in izberete prvi ponujeni rezultat.
Nekatere mogoče straši misel genskega cepiva (ja, ker je to tehnologija, ki sloni na mRNA molekuli, spada pod genska zdravila), ampak naj povem, da se molekula, kot je mRNA, ne more vgraditi v človeški genom, predvsem zaradi svoje nestabilnosti, predhodno potrebnega prepisa v DNA, ki je encimsko uravnavan, ljudje pa tega encima nimamo in zaradi zahtevnega transporta iz celične vsebine v celično jedro. In prav ta nezmožnost vgraditve mRNA molekule v genom predstavlja eno izmed največjih prednosti tovrstnega cepiva, hkrati pa nam njegova aplikacija s pomočjo maščobnih molekul omogoča vnos najmanjšega možnega števila dodatkov in adjuvansov, ki so v drugih cepivih zaradi njegove stabilnosti velikokrat prisotni. Tovrstna genska zdravila se že več let (zaenkrat le na nivoju kliničnih študij) uporabljajo za gensko zdravljenje raka in tudi zdravljenje živali.
In kot zanimivost, ki, opozarjam, ne velja za mRNA cepiva, saj ta vsebujejo le »golo« mRNA – popolne virusne RNA se neprestano vključujejo in izključujejo v oz. iz človeškega genoma in sama virusna RNA predstavlja kar 8 % celotnega našega genoma, njena vgraditev v genom pa je mogoča zaradi vseh potrebnih encimov in beljakovin, ki jih virus ima.
Avtorica: Hana Flajnik